近日,在线影院 戴家银教授团队在环境领域著名期刊《Environmental Science & Technology》上发表了题为《Exposure to a GenX Homologue Results in Sexually Dimorphic Bile Acid Metabolism Disorders Mediated by Hepatic PPARα in Mice》的研究成果。该研究系统揭示了新型全氟及多氟烷基化合物(PFAS)PEDMO2HpA在小鼠体内诱导的性别依赖性肝毒性,并首次阐明肝脏PPARα信号通路在PFAS所致胆汁酸代谢雌雄差异中发挥关键调控作用。论文第一作者为在线影院 任万兰博士,通讯作者为盛南副教授,第一完成和通讯单位均为在线影院 。
01 研究背景
全氟及多氟烷基物质(PFAS)是一类具有高度环境持久性和生物累积性的污染物,传统PFAS如PFOA已被列为持久性有机污染物并被认定为人类致癌物。为替代PFOA,以GenX及其同系物为代表的新型PFECAs被广泛使用,但其潜在健康风险尚未明确。PEDMO2HpA作为GenX的结构类似物,已在太湖流域水体、食品乃至人体血清中检出,其毒性机制尤其是性别差异效应亟待阐明。
目前,大多数毒理学研究以雄性动物为主,忽视了性别差异对毒性反应的影响。这种雄雌比较的缺乏,严重削弱了这些发现对于理解人类性别特异性风险的相关性。解决这一差距,对于准确评估环境污染物对两性的影响至关重要。肝脏作为PFAS的主要靶器官,具有显著的性别二态性,其在代谢、解毒和疾病易感性方面均存在性别差异。因此,开展PEDMO2HpA的性别特异性毒性研究具有重要科学和公共卫生意义。
02 研究内容
本工作针对新型全氟替代物PEDMO2HpA的肝毒性机制展开研究。首先通过28天亚慢性暴露实验评估了PEDMO2HpA(0-0.5 mg/kg/d)对小鼠的肝脏毒性效应。28天暴露后,雌性小鼠在0.1和0.5 mg/kg/d剂量组的血清和肝脏中PEDMO2HpA蓄积水平显著高于雄性,分别达到雄性的2.76倍和2.61倍(血清)及2.03倍和2.76倍(肝脏),表明存在明显的性别差异性生物蓄积(图1)。
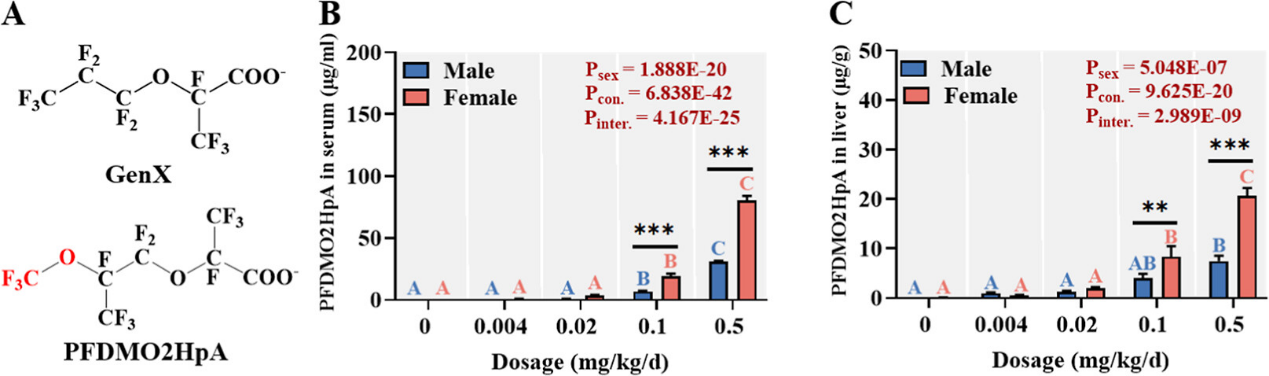
图1. 雌雄小鼠经28天暴露后血清和肝脏中PFDMO2HpA的化学结构及含量
毒性评价结果显示,雌性小鼠表现出更为严重的肝损伤:在0.5 mg/kg/d剂量下,雌性相对肝重量增加172.12%,显著高于雄性的118.49%;血清中肝损伤指标ALT、AST和ALP活性分别升高994.49%、84.50%和459.75%,且胆汁酸代谢紊乱尤为突出,血清和肝脏总胆汁酸水平分别增加687.76%和47.23%(图2)。即使在调整内暴露水平后,雌性仍表现出更高的生物学敏感性(图2E)。基于雌雄小鼠肝肿大、血清肝损伤指标水平及胆汁酸盐水平,推导得出PFDMO2HpA的参考剂量为6.67 ng/kg/d,低于其同系物HFPO-DA的参考剂量(30 ng/kg/d美国环保署)。团队前期研究发现,氟化工园区周边2-11岁儿童通过膳食摄入PFDMO2HpA的暴露水平达7.52-8.49 ng/kg/d,已超过参考剂量,而12岁以上居民的摄入水平也已经接近参考剂量,提示氟化工园区周边居民可能面临PFDMO2HpA暴露的潜在健康风险,值得进一步调查和公共卫生关注。

图2. PFDMO2HpA暴露对雄性和雌性小鼠肝损伤的影响
进一步通过转录组学探究了PFDMO2HpA的肝毒性机制(图3)。差异表达分析显示,随着剂量升高,雌雄共享差异基因数呈剂量依赖性增加。值得注意的是,雌鼠在0.1和0.5 mg/kg/d剂量下的性别特异性差异基因数量显著高于雄鼠。对差异表达基因进行富集,发现雌性富集通路数同样远超雄性,雌鼠特异性富集的5条通路中,胆汁分泌通路最为显著(图3B)。针对胆汁酸转运代谢相关基因的深入分析表明,多数基因(如Ephx1、Slco1a1、Abcc4等)在雌性中表达水平的变化更为显著(图3C)。
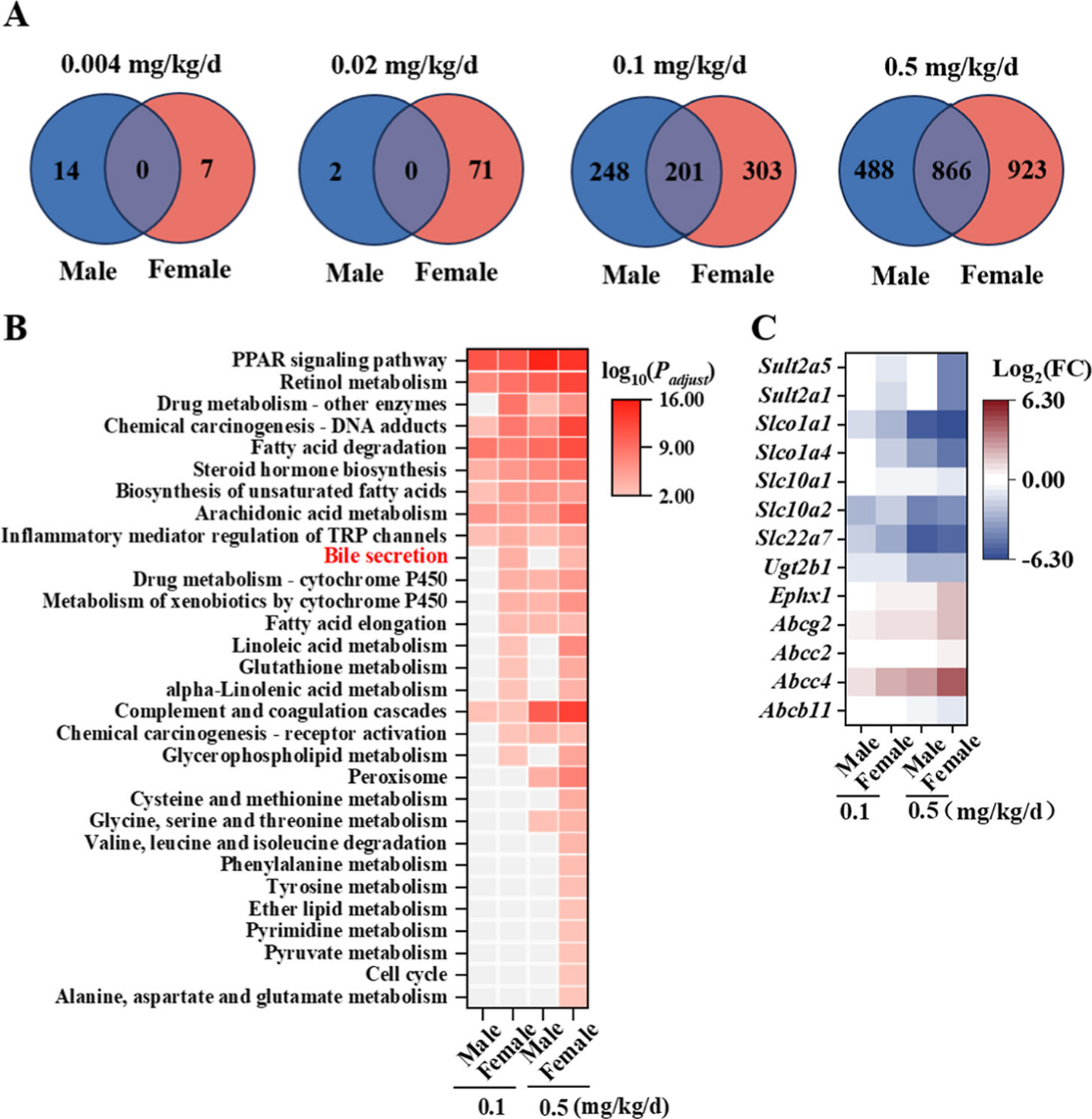
图3. PFDMO2HpA暴露后雌雄小鼠肝脏差异表达基因的生物信息学分析
小鼠肝脏中胆汁酸转运与合成相关蛋白的表达水平变化也表明雌性小鼠更敏感(图4)。胆汁酸合成的关键限速酶CYP7A1在雌性小鼠0.1及0.5 mg/kg/d剂量组中均显著上调,而雄性仅在0.5 mg/kg/d组出现上调,且上调幅度低于雌性。在转运相关蛋白中,SLCO1A1、ABCC4、EPHX1、SLC10A1、SLCO1A4和SULT2A1在相同暴露水平下,雌性中的表达变化幅度均大于雄性,表明雌性对PFDMO2HpA的毒性响应更为敏感(图4B)。基于上述结果,我们提出了一个机制假说:PFDMO2HpA通过激活PPARα抑制FXR信号通路,导致胆汁酸代谢紊乱;同时其通过抑制雌激素受体、上调雄激素受体产生性别差异性调控。这些核受体间的拮抗/协同作用共同解释了雌性小鼠更易出现胆汁酸蓄积和肝毒性的内在机制(图4C)。

图4. PFDMO2HpA暴露后雌雄小鼠胆汁酸合成及代谢相关蛋白的表达水平
为明确PPARα在介导PFDMO2HpA性别差异性肝毒性中的作用,本研究利用肝特异性PPARα敲除(PPARαΔHep)小鼠进行了验证,发现雌性小鼠的高蓄积性和严重胆汁酸代谢紊乱现象均显著缓解(图5)。PFDMO2HpA在雌性敲除小鼠血清中的浓度降至同剂量雄性的0.43–0.50倍,而在肝脏中时与雄性相当或略高(图5B–C)。尽管PPARα缺失后,PFDMO2HpA仍可在肝脏中蓄积,但肝损伤指标物无明显变化,且性别间差异消失(图5D-G)。此外,PPARα敲除后,PFDMO2HpA暴露引起的肝脏差异表达基因数量大幅减少,而胆汁酸代谢相关基因在雌雄小鼠体内均无显著扰动(图5H–I)。表明肝脏PPARα是介导PFDMO2HpA毒性性别差异的核心因子,其缺失可逆转雌性原有的高蓄积–高敏感性模式。
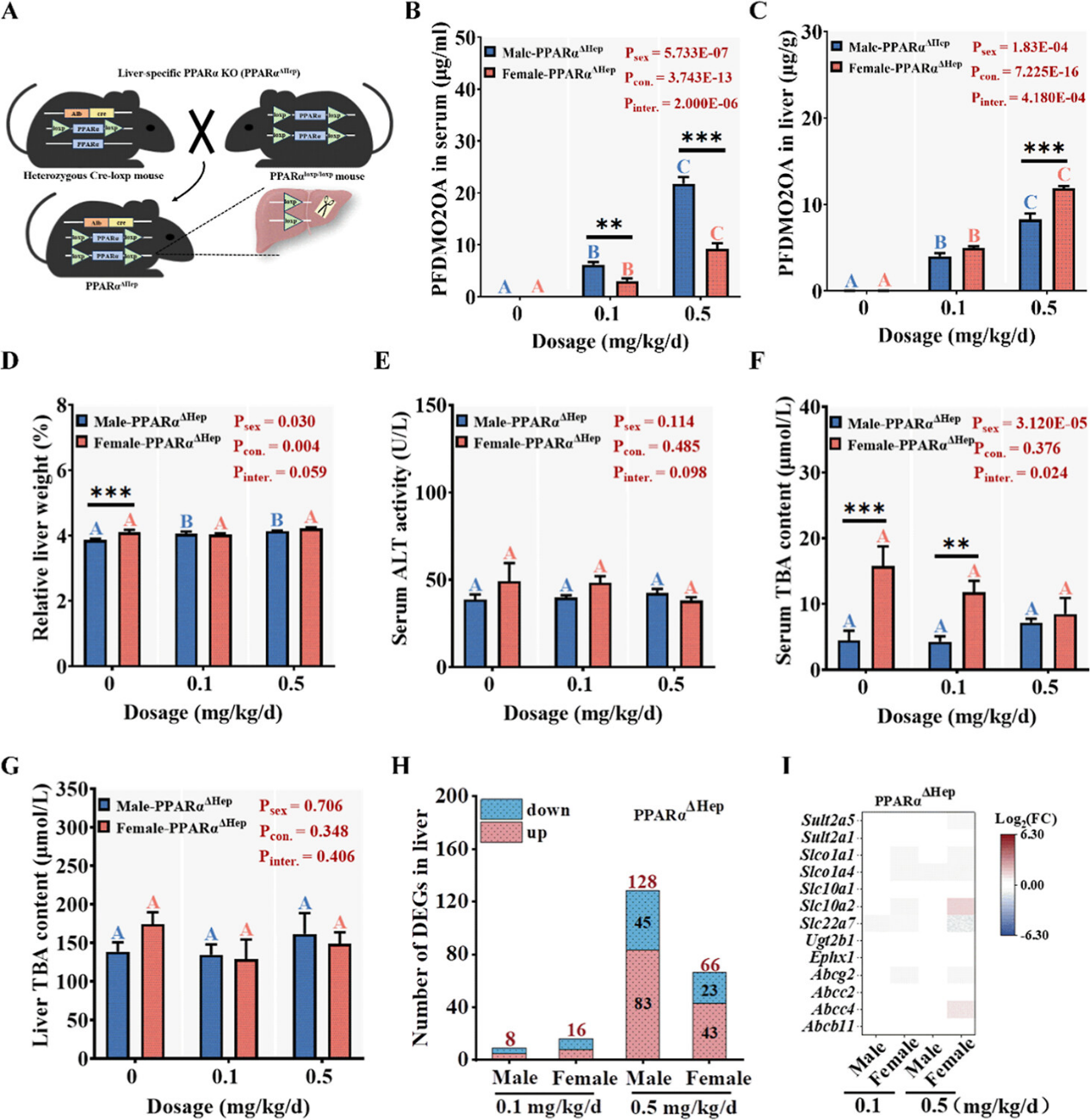
图5. 肝脏特异性PPARα敲除小鼠(PPARαΔHep)的构建,及PPARαΔhep雌、雄小鼠在暴露于PFDMO2HpA后,血清和肝脏中的PFDMO2HpA含量、肝毒性指标和转录组变化。
原文信息:Wanlan Ren et al., Exposure to a GenX Homologue Results in Sexually Dimorphic Bile Acid Metabolism Disorders Mediated by Hepatic PPARα in Mice. Environ Sci Technol. 2025 Nov 14. doi:10.1021/acs.est.5c08503. Online ahead of print.
作者简介

盛南,在线影院 副教授。主要研究方向包括:新型环境污染物的危害识别和高通量筛查;环境污染物与生物大分子的相互作用及其生物毒性效应;新型含氟化合物毒性效应的分子机制研究。主持国家自然科学基金委青年项目1项、面上项目1项。以项目骨干身份参加科技部重点研发项目2项、国家自然科学基金委区域联合基金重点项目2项、上海市科学技术委员会社发项目2项。近年来围绕新型含氟化合物的健康危害及机制,开展了环境调查、动物实验、计算机模拟等多层次研究,在Environ. Sci. Technol、Environ. Int.、J. Hazard. Mater.、Arch. Toxicol.等期刊共发表SCI论文40余篇。

戴家银,在线影院 ,特聘教授(2021.1-至今),入选国家高层次人才计划。先后主持科技部重点研发计划项目、国家自然科学基金委杰青、重点、重大国际合作等项目。长期从事全氟及多氟烷基化合物(PFAS)的筛查识别、环境行为及毒性机制研究。近年来在Environ Health Perspect.、Environ. Sci. Technol、Environ. Int.、J. Hazard. Mater.等国际著名学术刊物上发表PFAS相关的SCI论文120余篇,他引6000余次,连续入选爱思唯尔中国高被引学者。担任中国毒理学会环境与生态毒理学专业委员会常务委员、中国环境学会环境风险专业委员会委员、中国环境科学学会持久性有机污染物专业委员会委员、中国毒理学会计算毒理专业委员会委员,以及Environmental Pollution、Chemical Research in Toxicology杂志副主编。
